阿伏伽德罗常数
-
阿伏伽德罗常数
1摩尔的任何物质含有的微粒数相同,这个数的测量值:$N_A=6.02*10^{23} mol^{-1}$
简易物理 回复于:2022-02-20 23:34:21 -
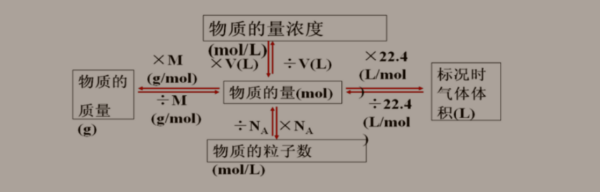
阿伏伽德罗常数计算
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
1.范围:气体(可为纯净物,也可以为混合物)
2.条件:同温同压同体积
3.特例:气体摩尔体积
推论:(为理想气体状态下)
1.$p_1 V_1/T_1=p_2 V_2/T_2$
2.$pV=nRT=mRT/M$(R为常数)
3.同温同压$V_1/V_2=N_1/N_2=n_1/n_2,p_1/p_2=n_1/n_2=N_1/N_2$
4.同温同体积$p_1/p_2=n_1/n_2=N_1/N_2$
5.同温同压同质量$V_1/V_2=M_2/M_1$
6.同温同压同体积$m_1/m_2=M_1/M_2$
简易物理 回复于:2022-02-20 23:43:24 -
阿伏伽德罗常数相关介绍
阿伏伽德罗的重大贡献,是他在1811年提出了一种分子假说:“同体积的气体,在相同的温度和压力时含有相同数目的分子。”这一假说称为阿伏伽德罗定律。
这一假说是根据J·L·盖-吕萨克在1809年发表的气体化合体积定律加以发展而形成的。阿伏伽德罗在1811年的著作中写道:“盖-吕萨克在他的论文里曾经说,气体化合时,它们的体积成简单的比例。如果所得的产物也是气体的话,其体积也是简单的比例。这说明了在这些体积中所作用的分子数是基本相同的。由此必须承认,气体物质化合时,它们的分子数目是基本相同的。”
阿伏伽德罗还反对当时流行的气体分子由单原子构成的观点,认为氮气、氧气、氢气都是由两个原子组成的气体分子。
当时,化学界的权威瑞典化学家J.J.贝采利乌斯的电化学学说很盛行,在化学理论中占主导地位。电化学学说认为同种原子是不可能结合在一起的。因此,英、法、德国的科学家都不接受阿伏伽德罗的假说。
一直到1860年欧洲100多位化学家在德国的卡尔斯鲁厄举行学术讨论会,会上康尼查罗散发了一篇短文《化学哲学教程概要》,才重新提起阿伏伽德罗假说。这篇短文引起了J.L.迈尔的注意,他在1864年出版了《近代化学理论》一书,许多科学家从这本书里了解并接受了阿伏伽德罗假说。
阿伏伽德罗定律已为全世界科学家所公认。阿伏伽德罗数是1摩尔物质所含的分子数,其数值是$6.02214076 \times 10^{23}$,是自然科学的重要的基本常数之一。
简易物理 回复于:2022-02-20 23:49:10 -
相关链接:
简易物理 回复于:2022-02-20 23:50:53 -
简易物理 回复于:2022-02-20 23:51:29
-
简易物理 回复于:2022-08-11 19:24:19